Ote:
Erot D2:n aktivaatiossa ja muutokset reseptoritiheydessä voivat vaikuttaa tähän tehokkuuteen ja muihin käyttäytymisen muutoksiin seksuaalisen kokemuksen aikana.
Edessä. Behav. Neurosci.
- 1Institute for Neuroscience, Texasin yliopisto, Austin, Austin, TX, USA
- 2Psykologian laitos, Texasin yliopisto, Austin, Austin, TX, USA
Dopamiini mediaalisella preoptisella alueella (mPOA) stimuloi seksuaalista aktiivisuutta miehillä. Tämän todistavat mikrodialyysi- ja mikroinjektiokokeet, jotka paljastavat, että mPOA:n dopamiinireseptoriantagonistit estävät seksuaalista aktiivisuutta, kun taas agonistit helpottavat käyttäytymistä. Mikrodialyysikokeet osoittavat samalla tavoin dopamiinin edistävän roolin, koska dopamiinitasot mPOA:ssa lisääntyvät pariutumisen myötä. Vaikka suurin osa todisteista viittaa mPOA:n dopamiinireseptoreiden tärkeään rooliin miesten seksuaalisen käyttäytymisen säätelyssä, ei ole aiemmin osoitettu, vaikuttaako seksuaalinen aktiivisuus tai seksuaalinen kokemus dopamiinireseptorin toimintaan mPOA:ssa. Tässä käytimme immunohistokemiallisia määrityksiä määrittääksemme, vaikuttavatko seksuaalisen aktiivisuuden tai kokemuksen vaihtelevat tasot Fos- tai D2-reseptorin immunoreaktiivisuutta sisältävien solujen lukumäärään. Tulokset osoittavat, että seksuaalinen kokemus helpotti myöhempää käyttäytymistä, nimittäin kokemus vähensi latenssia. Lisäksi Fos- tai D2-immunoreaktiivisten solujen lukumäärä korreloi seksuaalisen kokemuksen ja seksuaalisen aktiivisuuden tasojen kanssa. Seksuaalinen aktiivisuus lisäsi Fos-immunoreaktiivisuutta. Seksuaalisesti kokeneilla eläimillä oli myös huomattavasti enemmän D2-positiivisia soluja. Seksuaalisesti kokemattomilla eläimillä, jotka parittelivat ensimmäistä kertaa, oli suurempi prosenttiosuus D2-positiivisia Fos-soluja verrattuna seksuaalisesti kokeneisiin eläimiin. Lopuksi, kokemuksesta riippumatta, eläimillä, jotka harrastivat seksiä ennen lopettamista, oli huomattavasti enemmän D2-positiivisia soluja, jotka sisälsivät Fos:a, verrattuna eläimiin, jotka eivät parittaneet. Nämä havainnot ovat huomionarvoisia, koska seksuaalisesti kokeneet eläimet osoittavat lisääntynyttä seksuaalista tehokkuutta. Erot D2:n aktivaatiossa ja muutokset reseptoritiheydessä voivat vaikuttaa tähän tehokkuuteen ja muihin käyttäytymisen muutoksiin seksuaalisen kokemuksen aikana.
esittely
Dopamiinilla on tärkeä rooli miesten seksuaalisen käyttäytymisen säätelyssä (Hull ja Dominguez, 2015). Harkitse esimerkiksi aikaisempia raportteja, jotka osoittavat, että L-DOPA:n systeeminen antaminen johtaa useampaan rotiin, jotka osoittavat seksuaalista aktiivisuutta (Da Prada et ai., 1973; Paglietti et ai., 1978). Apomorfiinin, D1/D2-dopamiinireseptorin agonistin, antaminen johtaa myös siihen, että rotat tarvitsevat vähemmän aikaa siemensyöksyn saavuttamiseen ja suurempi osa niistä saavuttaa siemensyöksyn (Paglietti et ai., 1978). Sen lisäksi, että dopamiiniagonistit parantavat käyttäytymisen täydentäviä puolia, ne lisäävät psykogeenistä erektiota ja seksuaalista motivaatiota. Eläimet, jotka saivat selektiivisiä D2/D3 DA-reseptorin agonisteja, 7-OH-DPAT tai B-HT 920, osoittivat suuremman määrän psykogeenisiä erektioita vaikeapääsyisen kiimanaaraan läsnäollessa verrattuna rottiin, jotka saivat vehikkelikontrollia (Ferrari et ai., 2002). Vaikka agonistit helpottavat seksuaalista käyttäytymistä, antagonistit näyttävät heikentävän käyttäytymistä. Esimerkiksi D2-reseptorin antagonistin haloperidolin antaminen vähentää rottien nousujen, sisääntulojen ja siemensyöksyjen määrää ja lisää nousu- ja sisääntuloviiveitä rotilla (Pfaus ja Phillips, 1989). Dopamiiniantagonistien antaminen estää myös ennakoivaa seksuaalista käyttäytymistä, koska seksuaalisesti kokeneilla urosrotilla, jotka saavat lääkkeitä, on vähemmän ennakoivia muutoksia ennen seksuaalisesti vastaanottavan naaraan tuloa (Pfaus ja Phillips, 1991) kaksitasoisessa kammiossa, jota käytetään seksuaalisen motivaation analyysinä (Mendelson ja Pfaus, 1989). Lopuksi näyttää siltä, että sentraaliset, eivät perifeeriset, dopamiinireseptorit helpottavat erektiovastetta, koska systeemisesti annetun apomorfiinin aiheuttamat erektiot estivät haloperidoli (sentraalisesti aktiivinen dopamiiniantagonisti) mutta ei domperidoni (perifeerisesti aktiivinen dopamiiniantagonisti) hiirillä.Rampin et ai., 2003) ja rotilla (Pehek et ai., 1988a).
Vaikka useat aivoalueet säätelevät seksuaalista käyttäytymistä, erityisesti yksi alue, mediaalinen preoptinen alue (mPOA) on laajimmin tutkittu aivoalue, joka liittyy miesten seksuaalisen käyttäytymisen säätelyyn kaikissa selkärankaisissa.Hull ja Dominguez, 2015). Tämä korostus on perusteltua, koska mPOA saa epäsuoraa syötettä jokaiselta aistinvaraiselta modaliteettilta (Yksinkertaisesti ja Swanson, 1986) ja lähettää projektioita rakenteille, jotka ovat kriittisiä parittelun alkamisen ja kuvioinnin kannalta (Yksinkertaisesti ja Swanson, 1988). Useat välittäjäaineet ja hormonit vaikuttavat seksuaaliseen toimintaan toimimalla tällä alueella (Hull et ai., 1994; Dominguez ja Hull, 2005; Dominguez et ai., 2006; Hull ja Dominguez, 2006; Dominguez, 2009; Kleitz-Nelson et ai., 2010a,b). Ablaatiotutkimukset vahvistavat tämän alueen roolin seksuaalisen käyttäytymisen säätelyssä; vauriot heikentävät merkittävästi useita käyttäytymisen näkökohtia (Hull ja Dominguez, 2015). Sitä vastoin mPOA:n sähköinen stimulaatio rotilla vähensi siemensyöksyä varten tarvittavien intromissionien määrää, siemensyöksyä edeltävää aikaa ja siemensyöksyväliä.Malsbury, 1971; Rodríguez-Manzo et ai., 2000). mPOA:n stimulaatio saa myös aikaan erektiota ja virtsasukuelinten refleksin, mallin orgasmille.Marson ja McKenna, 1994; Giuliano et ai., 1997).
Ei ole yllättävää, että seksuaalinen aktiivisuus lisää myös hermostoa mPOA:ssa. Esimerkiksi elektrofysiologiset tallennukset seksuaalisesti kokeneiden apinoiden mPOA:ssa osoittivat lisääntynyttä aktiivisuutta sekä kun eläimet painoivat vipua tuodakseen naaraan lähemmäksi, että myös parittelun aikana, kun taas aktiivisuus loppui siemensyöksyssä (Oomura et ai., 1988). Muut kokeet, joissa käytettiin samanlaisia elektrofysiologisia tallennuksia rotilla, osoittivat myös, että parittelu lisää mPOA:n aktiivisuutta (Shimura et ai., 1994). Immunohistokemialliset tiedot heijastavat elektrofysiologisia tuloksia. Fos-immunoreaktiivisuus (ir), jota käytetään solujen aktiivisuuden mittana, lisääntyy mPOA:ssa sen jälkeen, kun urokset altistuvat kiimaisen naisen hajulle (Bressler ja Baum, 1996; Pfaus ja Heeb, 1997; Tobiansky ym., 2012). Kun verrataan Fos-iria parittelevien eläinten mPOA:ssa verrokkeihin, lisääntyvät parittelumäärät indusoivat lisääntyviä Fos-ir-määriä urosrottien mPOA:ssa (Robertson et ai., 1991; Baum ja Everitt, 1992; Veening ja Coolen, 1998; Nutsch et ai., 2014).
Vielä ei ole täysin selvää, muuttaako mPOA myös seksuaalisista kokemuksista johtuvia käyttäytymismuutoksia. Useat tutkimukset viittaavat kuitenkin siihen, että mPOA on ainakin osittain mukana näissä kokemuksen aiheuttamissa muutoksissa. Harkitse esimerkiksi seuraavia tutkimuksia, jotka yhdistävät seksuaalisen kokemuksen mPOA:n muutoksiin: seksuaalinen kokemus vaikuttaa parittelun aiheuttamaan aktiivisuuteen typpioksidisyntaasia sisältävissä soluissa urosrottien mPOA:ssa (Nutsch et ai., 2014); astrosyyttien määrä mPOA:ssa korreloi negatiivisesti siemensyöksyn latenssiin seksuaalisesti kokemattomilla mutta kokemattomilla urosrotilla (Will et ai., 2015); seksuaalinen kokemus lisää oksitosiinireseptoriproteiinin ja geenien ilmentymistä urosrottien mPOA:ssa (Gil et ai., 2011); kokemusperäinen urosten seksuaalisen käyttäytymisen tehostaminen sisältää dopamiini D1 -reseptoreita ja dopamiinin ja syklisen AMP:n säätelemän fosfoproteiini-32:n fosforylaatiota urosrottien mPOA:ssa (McHenry ym., 2012); seksuaalinen kokemus lisäsi androgeenireseptoreja uroshiirten mPOA:ssa (Swaney ym., 2012); seksuaalinen kokemus lisäsi typpioksidisyntaasi urosrottien mPOA:ssa. Tässä keskitytään D2-reseptoria sisältävien solujen parittelun aiheuttamaan stimulaatioon ja siihen, vaikuttaako tämä stimulaatio seksuaaliseen kokemukseen.
Ottaen huomioon mPOA:n integroiva ja keskeinen rooli miesten seksuaalisen käyttäytymisen säätelyssä, ei ehkä ole yllättävää, että dopamiini helpottaa seksuaalista aktiivisuutta toimimalla tällä alueella (Dominguez ja Hull, 2005). Dopamiinin lähteitä mPOA:lle ovat dopamiinia tuottavat solut periventrikulaarisessa tumassa (A14; Moore ja Lookingland, 1995), rostral zona incerta (A13; Björklund et ai., 1975) ja (ainakin naarasrotilla) myös ventraalinen tegmentaalinen alue (A10; Miller ja Lonstein, 2009). Selektiivisiä vaurioita, mikroinjektioita tai mikrodialyysitekniikoita käyttävät tutkimukset tukevat läheistä yhteyttä mPOA:n dopamiiniaktiivisuuden ja miesten lisääntyneen seksuaalisen toiminnan välillä. Ajattele, että dopamiinikuitujen 6-OHDA-leesiot mPOA:ssa 1 viikko ennen testausta yhdistettynä A14:n dopamiinisynteesin akuuttiin heikkenemiseen johtivat harvempiin siemensyöksyihin, pitempiin siemensyöksylatenssiin ja pidempiin siemensyöksyväliin (PEI; Bitran et ai., 1988). Dopamiiniantagonistien mikroinjektioilla on yhtä haitallinen vaikutus. Cis-flupentiksolin mikroinjektiot mPOA:han johtavat siihen, että rotat parittelevat harvemmin, ja ne, jotka parittelevat, saavuttavat vähemmän siemensyöksyjä (Pehek et ai., 1988b). Dopamiiniantagonistien mikroinjektiot heikentävät myös peniksen refleksejä, erityisesti cis-flupentiksolin mikroinjektiot heikensivät ex copula -peniksen refleksejä. Sitä vastoin dopamiiniagonistien mikroinjektiot parantavat käyttäytymistä. Apomorfiinin mikroinjektiot lisäävät siemensyöksyjen määrää ja vähentävät siemensyöksyn saavuttamiseen tarvittavaa aikaa sekä PEI:ssä vietettyä aikaa (Hull et ai., 1986). Apomorfiinin mikroinjektiot mPOA:han vähentävät myös peniksen ensimmäisen refleksin latenssia ja lisäävät erektioiden määrää ajoitetussa testissä (Pehek et ai., 1989), jotka osoittavat lisääntynyttä peniksen vastetta dopamiinireseptorin stimulaation jälkeen mPOA:ssa.
Lopuksi mikrodialyysikokeet osoittavat lisääntynyttä dopamiinin vapautumista rottien mPOA:ssa kiiman naaraan preparoitumisen jälkeen ja parittelun aikana.Hull ja Dominguez, 2015). Lisätodisteita siitä, että mPOA:n dopamiini edistää seksuaalista motivaatiota, ei pelkästään yleistä kiihottumista, tarjosi Kleitz-Nelson et ai. (2010a,b) käyttäen japanilaista viiriäistä, joilla on lyhyempi ajallinen parittelukuvio kuin rotilla ja joilla ei ole intromittoivaa elintä. Nämä tutkimukset osoittivat, että dopamiinitasot nousivat naisen läsnäollessa ja palasivat lähtötasolle naaraan poistamisen jälkeen; Viiriäiset, jotka eivät kuitenkaan onnistuneet pariutumaan, eivät osoittaneet tätä lisääntynyttä vapautumista (Kleitz-Nelson et ai., 2010b). Sitä vastoin urokset, jotka osoittivat merkittävää dopamiinin lisääntymistä preparoituneiden vuorovaikutusten aikana esteen takana, pariutuivat helposti naisten kanssa sen poistamisen jälkeen (Kleitz-Nelson et ai., 2010a).
Vaikka todisteiden valtaosa tukee dopamiinin ja sen reseptorien tärkeää säätelyroolia mPOA:ssa, ovatko erilaiset seksuaalisen aktiivisuuden tasot tai seksuaalinen kokemus eri tavoin stimuloivat dopamiinireseptoria sisältäviä soluja mPOA:ssa, tähän mennessä ei tiedetty. Tätä tarkoitusta varten käytimme immunohistokemiallisia määrityksiä määrittääksemme, vaikuttavatko seksuaalisen aktiivisuuden tai kokemuksen vaihtelevat tasot D2-kaltaisia dopamiinireseptoreita, Fos:a tai molempia sisältävien solujen lukumäärään urosrottien mPOA:ssa.
Materiaalit ja menetelmät
Aiheet
Kuusikymmentä Long-Evans-urosrottaa (Harlan, Indianapolis, IN; 90 päivän ikäisiä saapuessaan) pidettiin yksittäin suurissa muovihäkeissä ilmastoiduissa tiloissa 14 h valo/pimeys-jaksolla valot sammutettuna klo 10. :10 ja/on klo 00:8 Ruoka ja vesi olivat vapaasti saatavilla. Tyypilliset naaraat (n = 17) poistettiin munasarjat ketamiinihydrokloridin (50 mg/kg) ja ksylatsiinihydrokloridin (4 mg/kg) nukutuksessa. Ne tuotiin käyttäytymiskiimaan 4 µg estradiolibentsoaattia (sc) 48 tuntia ennen ja 400 µg (sc) progesteronia 4 tuntia ennen testausta. Käyttäytymiskyky vahvistettiin asettamalla naaras naarasuroksen kanssa vähän ennen testin alkamista. Kaikki toimenpiteet suoritettiin kansallisten terveysinstituuttien eläinten käyttöä koskevien ohjeiden mukaisesti, ja ne hyväksyttiin Austinin Texasin yliopiston Institutional Animal Care and Use -komiteassa.
Urosrotat määritettiin satunnaisesti johonkin seuraavista neljästä tilasta: eläimet, jotka olivat seksuaalisesti kokeneita, mutta jotka eivät parittaneet teurastuspäivänä (kokenut, mutta ei sukupuolta, Exp-NoSex); eläimet, jotka olivat seksuaalisesti kokeneita ja myös pariutettuja uhrauspäivänä (kokenut ja sukupuoli, Exp-Sex); eläimet, jotka olivat seksuaalisesti naiiveja eivätkä parittaneet uhrauspäivänä (kokemattomat ja ei seksiä, Inexp-NoSex); eläimet, jotka olivat seksuaalisesti naiiveja, mutta kokivat parittelun ensimmäistä kertaa uhrauspäivänä (kokemattomat ja sukupuoli, Inexp-Sex).
Seksuaalinen kokemus koostui parittelusta seksuaalisesti vastaanottavan naaraan kanssa 90 minuutin ajan, joka toinen päivä, 6 päivää ennen teurastuspäivää, yhteensä 9 tuntia. 6. päivänä eläimiä tarkkailtiin vahvistamaan, että ne saavuttivat vähintään kaksi siemensyöksyä viimeisen kokemuksen aikana. Kolme eläintä, jotka eivät täyttäneet tätä kriteeriä, suljettiin pois lisätestauksista. Viimeisen kokemuspäivän ja koepäivän, jolloin eläimet lopetettiin, erotti kaksi päivää. Käyttäytymistiedot hankittiin ja analysoitiin testipäivänä, joka oli 2 päivää viimeisen kokemuksen jälkeen. Pariutuneissa ryhmissä olevien eläinten annettiin pariutua yhteen siemensyöksyyn. Eläimet, jotka eivät kyenneet pariutumaan 1 tunnin kuluttua, poistettiin ja suljettiin pois lisäanalyysistä. Sukupuolikontrollit suoritettiin, mutta naaraita ei tuotu kotihäkkiinsä. Kaikki eläimet lopetettiin natriumpentobarbitaalin (100 mg/kg) yliannoksella 1 tunti siemensyöksystä tai testin päättymisen jälkeen.
immunohistokemia
Rotille perfusoitiin transkardiaalisesti suolaliuosta pentobarbitaalipuudutuksessa, mitä seurasi 4 % paraformaldehydillä 0.1 M fosfaattipuskurissa (PB; pH = 7.35). Aivot poistettiin, jälkifiksoitiin 1 tunnin ajan samassa kiinnitysaineessa huoneenlämpötilassa ja säilytettiin 30 % sakkaroosissa 4 °C:ssa. Koronaalileikkeet leikattiin 35 μm:n korkeudella ja säilytettiin kylmältä suojaavassa liuoksessa. MPOA:n sisältäville leikkeille tehtiin immunohistokemiallinen värjäys Fos- ja D2-dopamiinireseptoreille. Pesut PB:ssä, 4 x 5 minuutin ajan, ennen kaikkia inkubaatioita. Leikkeille tehtiin seuraavat inkubaatiot: 1 % H2O2 PB:ssä ja sitten blokattu 2 % normaalilla vuohen seerumilla ja 1 % Tween-20:llä (estoliuos); hiiren anti-Fos primaarinen vasta-aine (1:5000; Santa Cruz Biotechnology, Santa Cruz, CA, USA) estoliuoksessa, yön yli huoneenlämpötilassa. Seuraavana päivänä leikkeitä inkuboitiin anti-hiiri-biotinyloidussa sekundaarisessa vasta-aineessa (1:500 estoliuoksessa; Vector Labs, Burlingame, CA, USA). Immunoreaktiivisuus visualisoitiin diaminobentsidiini (DAB)-nikkeli-kromogeeniliuoksella (Sigma, St. Louis, MO, USA), jolloin saatiin purppuranmusta sakka, inkubaatio kesti 10 minuuttia. Pesun jälkeen perusteellisesti PB:llä leikkeitä inkuboitiin sitten kanin primaarisen anti-D2-vasta-aineen ja estoliuoksen kanssa yön yli huoneenlämpötilassa (1:6000; EMD Millipore, Billerica, MA, USA). Seuraavana päivänä inkubointi anti-kanin biotinyloidussa sekundaarisessa vasta-aineessa (1:500 estoliuoksessa; Vector Labs, Burlingame, CA, USA) edelsi avidiini-biotiinikonjugaattia ja visualisoitiin DAB-kromogeeniliuoksella ilman nikkeliä, jolloin saatiin ruskea. saostua. Osat kuivattiin, asennettiin ja peitettiin DPX:llä (VWR, Radnor, PA, USA). Negatiivisten kontrollien osalta leikkeille tehtiin sama immunovärjäysmenettely, paitsi että D2, Fos tai molemmat primaariset vasta-aineet jätettiin pois. Kun kudosta otettiin käyttöön ja poistettiin inkuboinneista, kokeilijat olivat varovaisia minimoimaan ensimmäisen ja viimeisen kudossarjan erottavan siirtoajan. Siirtoaika oli keskimäärin 40 sekuntia kaikissa inkubaatioissa, mukaan lukien DAB.
Valomikroskopiaa käytettiin D2-ir-, Fos-ir- ja kaksoisleimattuja soluja sisältävien solujen lukumäärän määrittämiseen. mPOA tutkittiin kahdenvälisesti ja immunoleimatut solut laskettiin 300 × 400 μm:n alueelta mediaalisessa preoptisessa tumassa (MPN), joka on mPOA:n keskeinen tuma. Laskenta suoritettiin manuaalisesti käyttämällä ImageJ:tä. Aivot leikattiin 35 μm neljään yhtä suureen osaan. Kudos analysoitiin yhdestä näistä osista, joten jokaisen viipaleen välillä oli 105 μm. Solulukujen keskiarvo laskettiin molemmilta puolipalloilta ja kuudelta osalta. Kuusi osaa jokaisesta eläimestä laskettiin kahdenvälisesti koordinaattien mukaan Swanson (2004).
Länsi-immunoblottaus
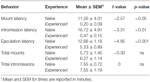
Immunohistokemiaa varten värjäsimme käyttämällä kanin polyklonaalista anti-D2-dopamiinireseptoria. Valmistajan kuvauksessa D2-vasta-aineesta todetaan, että se tunnistaa D2-reseptorin rotissa, ei ristireagoi muiden dopamiinireseptorien kanssa ja osoittaa minimaalista ristireaktiivisuutta reseptorin lyhyen muodon (D2Sh) kanssa. Tämä on tärkeää huomata, koska vaikka D2Sh sijaitsee ensisijaisesti pre-synaptisesti (eli autoreseptori), D2Lh-pitkämuotoinen toimii enemmän klassisena postsynaptisena reseptorina, ja kvantifiointimme olivat D2:ta sisältäviä soluja, eivät kuituja. Lisäksi D2:n ennustettu koko on noin 50 kDa. Valmistajan omat immunoblottauskokeet, joissa käytettiin tätä D2-vasta-ainetta, havaitsivat kuitenkin kaksi vyöhykettä kohdilla ~48 ja ~51 kDa. Immunoblottauskokeet, joissa käytettiin muita D2-vasta-aineita, raportoivat myös yli 50 kDa:n vyöhykkeitä (Farooqui et ai., 1992; Sakata et ai., 1992; Boundy et ai., 1993). Tästä syystä suoritimme Western-immunoblottauskokeita D2-vasta-aineen spesifisyyden testaamiseksi.
Western-immunoblottausta varten aivonäytteet homogenisoitiin ja puhdistettiin RIPA-puskurissa (Pierce) proteaasi-inhibiittoritableteilla (Roche) ja proteiinipitoisuus arvioitiin NanoDrop-järjestelmällä. 10 μg proteiinikuormatilavuus erotettiin elektroforeesilla ja verrattiin käyttämällä PrecisionPlus värjäytymättömiä standardeja (BioRad). Positiivisiksi kontrolleiksi kerättiin aivonäytteitä alueilta, joilla tiedettiin olevan suhteellisen korkea D2-reseptoripitoisuus, nimittäin dorsaalinen striatum (DS) ja posterior cortex (CTX; Lidow et ai., 1989; Meador-Woodruff et ai., 1989); negatiiviset kontrollit sisälsivät maksasta (LIV) ja munuaisista (KID) kerätyt näytteet. Näytteet siirrettiin PVDF:hen ja altistettiin kanin anti-D2-vasta-aineelle (1:4000, Millipore) ja sitten vuohen anti-kanin HRP:lle sekundaariselle (1:30,000 2, Bio-Rad) estävässä puskurissa, joka sisälsi 50 % normaalia vuohen seerumia. Vyöhykkeet visualisoitiin käyttämällä ECL-kemiluminesenssia. Tulokset vahvistivat vyöhykkeen olemassaolon ~50 kDa:n kohdalla, mutta löysimme yli XNUMX kDa:n vyöhykkeitä (katso kuva 1). Tästä lähtien määrittelemme kokeissamme D2-immunopositiivisen värjäytymisen oletetun D2-kaltaisen dopamiinireseptorin osoituksena.
 Kuvio 1. D2-dopamiinireseptoriproteiinin vasta-aineen Western-immunoblottausanalyysi, joka on kasvatettu kaniinissa. Molekyylipainoa kuvaavat tikkaat ovat oikealla dorsaalisen striatumin (DS), takakuoren (CTX), maksan (LIV) ja munuaisnäytteiden (KID) vasemmalla puolella. D2-reseptoriproteiinin molekyylipaino on 51 kDa. Immunoblottausanalyysit paljastavat aivonäytteissä muiden juovien lisäksi ~50 kDa:n vyöhykkeen. Tämä vyöhyke puuttuu sekä maksa- että munuaisnäytteistä.
Kuvio 1. D2-dopamiinireseptoriproteiinin vasta-aineen Western-immunoblottausanalyysi, joka on kasvatettu kaniinissa. Molekyylipainoa kuvaavat tikkaat ovat oikealla dorsaalisen striatumin (DS), takakuoren (CTX), maksan (LIV) ja munuaisnäytteiden (KID) vasemmalla puolella. D2-reseptoriproteiinin molekyylipaino on 51 kDa. Immunoblottausanalyysit paljastavat aivonäytteissä muiden juovien lisäksi ~50 kDa:n vyöhykkeen. Tämä vyöhyke puuttuu sekä maksa- että munuaisnäytteistä.
Data Analysis
Kaksisuuntainen varianssianalyysi (ANOVA; parittelu × kokemus) suoritettiin immunopositiivisten solujen lukumäärän erojen tutkimiseksi. Myös Welch kaksi näyte t-testeillä tutkittiin käyttäytymismittareiden eroja. Tietojen analyysit suoritettiin R:llä (versio 3.2.2).
tulokset
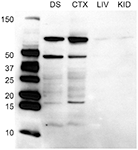
Kaksisuuntainen ANOVA paljasti sukupuolen merkittävän päävaikutuksen fos-positiivisten solujen lukumäärään mPOA:ssa (F(1,40) = 178.915, p < 0.001), jolloin eläimillä, jotka olivat harrastaneet seksiä ennen lopettamista, oli merkittävästi enemmän fos-ir-soluja. Kokemuksella ei kuitenkaan ollut pääasiallista vaikutusta (F(1,40) = 0.800, p = 0.376), eikä myöskään ollut seksiä kokemuksen perusteella (F(1,40) = 0.562, p = 0.4579; kuva 2A). Kuvassa on lämpökartta, joka kuvaa fos-positiivisten solujen määrän ja seksuaalisen käyttäytymisen välistä suhdetta 3A.
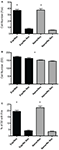 Kuvio 2. Seksuaalisen aktiivisuuden ja seksuaalisen kokemuksen vaikutukset D2- ja Fos-immunoreaktiivisuuteen urosrottien mPOA:ssa. (A) Eläimillä, jotka parittelivat ennen lopettamista, oli merkittävästi enemmän fos-positiivisia soluja. (B) Eläimillä, joilla oli seksuaalista kokemusta, oli merkittävästi enemmän D2-immunopositiivisia soluja verrattuna naiiveihin eläimiin. (C) Sukupuolen ja kokemuksen välillä oli vuorovaikutusta Fosia sisältävien D2-solujen prosenttiosuudessa; erityisesti naiiveilla eläimillä, jotka parittelivat ensimmäistä kertaa, oli huomattavasti suurempi prosenttiosuus D2-soluista, jotka ilmensivät Fos:a. (*p <0.05).
Kuvio 2. Seksuaalisen aktiivisuuden ja seksuaalisen kokemuksen vaikutukset D2- ja Fos-immunoreaktiivisuuteen urosrottien mPOA:ssa. (A) Eläimillä, jotka parittelivat ennen lopettamista, oli merkittävästi enemmän fos-positiivisia soluja. (B) Eläimillä, joilla oli seksuaalista kokemusta, oli merkittävästi enemmän D2-immunopositiivisia soluja verrattuna naiiveihin eläimiin. (C) Sukupuolen ja kokemuksen välillä oli vuorovaikutusta Fosia sisältävien D2-solujen prosenttiosuudessa; erityisesti naiiveilla eläimillä, jotka parittelivat ensimmäistä kertaa, oli huomattavasti suurempi prosenttiosuus D2-soluista, jotka ilmensivät Fos:a. (*p <0.05).
 Kuva 3. Lämpökartat, jotka kuvaavat korrelaatiota seksuaalisen käyttäytymisen ja D2- tai Fos-immunoreaktiivisuuden välillä urosrottien mPOA:ssa. (A) Intromissionien lukumäärän ja Fos-immunoreaktiivisuuden välillä oli merkittävä positiivinen korrelaatio naiiveilla eläimillä, jotka pariutuivat ensimmäistä kertaa. (B) Seksuaalisesti kokeneiden eläinten lisääntymislatenssin ja D2-immunopositiivisten solujen lukumäärän välillä oli merkittävä negatiivinen korrelaatio. (C) Intromissionien lukumäärän ja Fos-soluja sisältävien D2-solujen prosenttiosuuden välillä oli merkittävä positiivinen korrelaatio naiiveilla eläimillä, jotka pariutuivat ensimmäistä kertaa. (ML, mount latenssi; IL, intromission latenssi; EL, siemensyöksyn latenssi; PEI, siemensyöksyn jälkeinen aikaväli; M, mounts; I, intromissions).
Kuva 3. Lämpökartat, jotka kuvaavat korrelaatiota seksuaalisen käyttäytymisen ja D2- tai Fos-immunoreaktiivisuuden välillä urosrottien mPOA:ssa. (A) Intromissionien lukumäärän ja Fos-immunoreaktiivisuuden välillä oli merkittävä positiivinen korrelaatio naiiveilla eläimillä, jotka pariutuivat ensimmäistä kertaa. (B) Seksuaalisesti kokeneiden eläinten lisääntymislatenssin ja D2-immunopositiivisten solujen lukumäärän välillä oli merkittävä negatiivinen korrelaatio. (C) Intromissionien lukumäärän ja Fos-soluja sisältävien D2-solujen prosenttiosuuden välillä oli merkittävä positiivinen korrelaatio naiiveilla eläimillä, jotka pariutuivat ensimmäistä kertaa. (ML, mount latenssi; IL, intromission latenssi; EL, siemensyöksyn latenssi; PEI, siemensyöksyn jälkeinen aikaväli; M, mounts; I, intromissions).
Kaksisuuntainen ANOVA paljasti merkittävän kokemuksen päävaikutuksen oletettujen D2-ir-solujen lukumäärään mPOA:ssa (F(1,40) = 7.417, p < 0.01), jolloin seksuaalisesti kokeneilla eläimillä oli merkittävästi enemmän D2-ir-soluja riippumatta seksuaalisesta aktiivisuudesta ennen lopettamista (kokenut, 167 ± 3.9; kokematon 148 ± 2.3; katso kuva 2B). Seksillä ei kuitenkaan ollut päävaikutusta (F(1,40) = 2.564, p = 0.117), eikä myöskään ollut seksiä kokemuksen perusteella (F(1,40) = 0.119, p = 0.732; kuva 3B). Kuvassa on lämpökartta, joka kuvaa D2-ir-solujen määrän ja seksuaalisen käyttäytymisen välistä suhdetta 3B.
Kaksisuuntainen ANOVA paljasti sukupuolen merkittävän päävaikutuksen fosia ilmentävien D2-ir-solujen prosenttiosuuteen mPOA:ssa.F(1,40) = 162.831, p < 0.001), mutta ei kokemuksen päävaikutus (F(1,40)= 0.324, p = 0.572). Siellä oli kuitenkin merkittävää seksiä kokemuksen kautta (F(1,40) = 4.390, p < 0.05). Tämän merkittävän vuorovaikutuksen hajoaminen paljasti, että seksuaalisesti naiiveilla eläimillä, jotka parittelivat ensimmäistä kertaa, oli huomattavasti suurempi osuus D2-positiivisista soluista, jotka ilmensivät Fos-soluja seksuaalisesti kokeneisiin eläimiin verrattuna, katso kuva. 2C. Fos:a ilmentäneiden D2-positiivisten solujen fraktiossa ei kuitenkaan ollut merkittävää eroa seksuaalisesti naiivien ja kokeneiden eläinten välillä, jotka eivät parittaneet ennen lopettamista. Lopuksi, kokemuksesta riippumatta eläimillä, jotka harrastivat seksiä ennen lopettamista, oli huomattavasti enemmän D2-ir-soluja, jotka ilmensivät Fos:a, kuin eläimillä, jotka eivät parittaneet (kuva 3C). Kuvassa on lämpökartta, joka kuvaa Fosia ilmentäneiden D2-ir-solujen fraktion ja seksuaalisen käyttäytymisen välistä suhdetta. 3C.
Fos-positiivisten solujen prosenttiosuuden analyysit, joissa ei ole D2:n kaltaisia reseptoreita, käyttäen kaksisuuntaista ANOVAa, paljastivat sukupuolen päävaikutuksen (F(1,42) = 15.795, p < 0.001), jossa D2:ta sisältämättömien Fos-solujen prosenttiosuus oli suurempi eläimillä, jotka eivät parituneet ennen lopettamista. Katso kuva 4 edustavia mikrokuvia varten. Seuraavassa on niiden fos-positiivisten solujen prosenttiosuus, jotka eivät sisällä D2:ta (keskiarvo ± SEM): naiivit/ei sukupuolta, 11.45 ± 1.4; naiivi/sukupuoli, 7.98 ± 0.8; kokenut/ei seksiä, 13.04 ± 1.4; kokenut/sukupuoli, 6.51 ± 1.0.
 Kuva 4. Mikrokuvat, jotka esittävät edustavia kolokalisoituja D2- ja Fos-immunoreaktiivisia soluja (mustat nuolet) yhdessä D2-immunoreaktiivisten solujen (valkoiset nuolet) kanssa mPOA:ssa. Edustavia mikrovalokuvia otettu () seksuaalisesti kokenut urosrotta, joka pariutui testauspäivänä ja (B) seksuaalisesti kokenut rotta, joka ei paritellut testauspäivänä. Mittakaava on 20 μm.
Kuva 4. Mikrokuvat, jotka esittävät edustavia kolokalisoituja D2- ja Fos-immunoreaktiivisia soluja (mustat nuolet) yhdessä D2-immunoreaktiivisten solujen (valkoiset nuolet) kanssa mPOA:ssa. Edustavia mikrovalokuvia otettu () seksuaalisesti kokenut urosrotta, joka pariutui testauspäivänä ja (B) seksuaalisesti kokenut rotta, joka ei paritellut testauspäivänä. Mittakaava on 20 μm.
Sen varmistamiseksi, että muutokset immunoreaktiivisuudessa olivat spesifisiä mPOA:lle, immunoreaktiivisten solujen lukumäärä Fos:lle ja D2:lle tutkittiin myös Brocan diagonaalivyöhykkeellä, alueella, joka löydettiin samalla anteroposteriorisella tasolla kuin mPOA. Analyysit eivät paljastaneet merkittäviä eroja D2-ir-, Fos-ir- tai kolokalisoituneiden solujen lukumäärässä minkään neljän ryhmän välillä. Erityisesti D2-ir-solujen lukumäärä oli seuraava jokaisessa ryhmässä (keskiarvo ± SEM): Exp-No Sex, 105 ± 3.08; Exp-Sex, 104 ± 4.62; Naiivi-ei seksiä, 118 ± 5.46; Naiivi-Seksi, 112 ± 6.01. Fos-ir-solujen lukumäärä oli seuraava jokaisessa ryhmässä (keskiarvo ± SEM): Exp-No Sex, 1.5 ± 0.7; Exp-Sex, 2.7 ± 0.6; Naiivi-ei seksiä, 1.5 ± 0.58; Naiivi-Seksi, 3.9 ± 0.6. Sekä D2:n että Fos:n sisältävien solujen lukumäärä oli seuraava jokaisessa ryhmässä (keskiarvo ± SEM): Exp-No Sex, 1.3 ± 0.60; Exp-Sex, 1.85 ± 0.36; Naiivi-ei seksiä, 1.3 ± 0.56; Naiivi-Seksi, 2.5 ± 0.48.
Käyttäytymismittaukset on esitetty tässä taulukossa 1. Aiempien havaintojen mukaisesti kokeneilla eläimillä oli lyhyemmät latenssit nousemiseen, sisäänpudotukseen ja ejakulaatioon. Seksuaalinen kokemus ei vaikuttanut nousu- tai tutustumistiheyteen.
Keskustelu
Tutkimukset osoittavat, että mPOA:han mikroinjektoidut dopamiiniagonistit helpottavat seksuaalista käyttäytymistä, kun taas dopamiiniantagonistien mikroinjektiot heikentävät parittelua, sukupuolielinten refleksejä ja seksuaalista motivaatiota (Hull ja Dominguez, 2015). Lisäksi dopamiinitasot nousevat mPOA:ssa ennen parittelua tapahtuvan altistuksen aikana kiimaiselle naiselle ja parittelun aikana (Hull ja Dominguez, 2015). Muiden tutkimusten mukaisesti osoitimme, että parittelu lisää Fos:a urosrottien mPOA:ssa (Hull ja Dominguez, 2015). Osoitimme myös, että seksuaalinen kokemus helpottaa miesten seksuaalista käyttäytymistä mitattuna lyhennetyllä latenssilla parittelun aloittamiseksi ja siemensyöksyksi saavuttamiseksi. Tämä on myös linjassa aikaisempien tutkimusten kanssa. Olemme ensimmäiset, jotka osoittavat, että pariutuminen lisää Fos-pitoisuutta D2:ta sisältävissä soluissa mPOA:ssa ja lisäksi, että tämä stimulaatio on kokemuksesta riippuvaista. Havaitsimme myös, että toistuva seksuaalinen kokemus lisää D2:n kaltaista immunoreaktiivisuutta sisältävien solujen määrää. Mielenkiintoista on, että D2:ta sisältämättömien Fos-solujen määrä oli suurempi eläimillä, jotka eivät parituneet ennen lopettamista, mikä tukee dopamiinireseptoria sisältävien solujen merkitystä parittelussa, koska parittelu stimuloi enimmäkseen D2:ta sisältäviä soluja. Lopuksi havaitsimme korrelaatioita Fos-ir-solujen ja intromissionien, D2-ir- ja mount-latenssin sekä Fos/D2- ja intromissionien prosenttiosuuden välillä kokemuksen funktiona.
Tuloksemme osoittavat, että pariutuminen stimuloi soluja, jotka sisälsivät D2:n kaltaisia reseptoreita mPOA:ssa. Yleensä reseptorien D1-perheen (D1 ja D5) reseptorien aktivointi stimuloi adenylyylisyklaasia, kun taas D2-perheen reseptorit (D2, D3 ja D4) estävät cAMP:n muodostumista estämällä adenylaattisyklaasientsyymiä (Sibley ja Monsma, 1992; Gingrich ja Caron, 1993). Näin ollen D1:n ja D2:n erityisosuuksien erottaminen mPOA:ssa miesten seksuaalisen käyttäytymisen ilmentymiseen tulee tärkeäksi. Ja vaikka emme suoraan tutkineet D1-reseptorien aktivaatiota, haluaisimme spekuloida havainteidemme merkityksestä D1/D2:n roolista seksuaalisen käyttäytymisen mPOA:ssa. Hull-malli dopaminergisestä vaikutuksesta sukupuoleen (Dominguez ja Hull, 2005) väittää, että mPOA:n D1- ja D2-reseptorien stimulaatiolla voi olla synergistisiä ja joitain vastakkaisia käyttäytymisvaikutuksia.
D1-reseptorien stimulaatio lisäsi ex copula -erektioiden määrää, mutta vähensi siemenemissioiden määrää; päinvastoin D1-antagonistilla oli päinvastainen vaikutus, heikensi erektiota ja lisäsi siemenpäästöjä (Hull et ai., 1992). Siksi D1:n kaltaisten reseptorien stimulointi voi tarjota "moottorin" erektiolle. Tässä samassa tutkimuksessa pieni apomorfiiniannos lisäsi erektiota, ja D1-antagonisti SCH-23390 esti tämän vaikutuksen kokonaan ja D2-antagonisti raklopridi esti osittain, mikä viittaa siihen, että molemmat reseptorityypit vaikuttivat apomorfiinin vaikutuksiin, mutta D1-reseptori. oli tehokkaampi. Toisaalta suuri annos apomorfiinia lisäsi siemenpäästöjä, ja tämän vaikutuksen esti D2-antagonisti raklopridi ja tehosti hieman D1-antagonisti SCH-23390 (Markowski et ai., 1994), mikä viittaa siihen, että D2:n kaltaisten reseptorien voimakas stimulaatio voi muuttaa autonomista tasapainoa edistämään siemenemissiota ja estämään erektiota. Siksi mPOA:n D1- ja D2-reseptoreilla on erilaiset aktivaatiokynnykset ja erilaiset vaikutukset sukupuolielinten refleksien autonomiseen säätelyyn. Lopuksi THP:n mikroinjektiot mPOA:han helpottavat parittelua (Markowski et ai., 1994), kun taas suuri annos D2-agonistia kinoloraania viivästytti parittelun alkamista ja hidasti parittelunopeutta samalla, kun se vähensi siemensyöksyn laukaisemiseen tarvittavien intromissionien määrää (Hull et ai., 1989). Siksi synergiaa D1- ja D2-reseptorien välillä esiintyy mPOA:ssa, koska D2-reseptorien aktivointia voidaan vaatia estämään erektio, jotka sitten aktivoituvat stimuloimalla D1-reseptoreita alhaisilla tai kohtalaisilla dopamiinitasoilla. Sitä vastoin D2-reseptorien voimakas tai pitkittynyt stimulaatio voi muuttaa autonomista tasapainoa edistämään siemensyöksyä. Tämän mallin mukaan korkean kynnyksen mekanismi, joka aktivoituu D2-reseptorien stimuloimalla, helpottaa siemenemissiota ja estää erektiota (eli sympaattista aktivaatiota); jos totta, niin tuloksemme ovat tämän mallin mukaisia. Nämä ovat myös yhdenmukaisia muiden eläinmallien kanssa, kuten japanilaisen viiriäisen kanssa, jossa D1- ja D2-manipulaatioilla on erilaiset vaikutukset ruokahaluiseen ja täydentävään käyttäytymiseen (Balthazart et ai., 1997). Ejakulaatiot tutkimuksessamme liittyivät D2:ta sisältävien solujen lisääntyneeseen stimulaatioon, mistä on osoituksena Fos:n läsnäolo D2:ta sisältävissä soluissa. Tämä on jälleen yhdenmukainen Hull-mallin kanssa, jossa D2-reseptoria sisältävien solujen voimakkaampi dopaminerginen stimulaatio edeltää siemensyöksyä. Tuloksemme osoittivat myös, että seksuaalisesti kokemattomilla eläimillä oli enemmän D2:ta sisältävien solujen aktivaatiota, mikä viittaa siihen, että nämä eläimet tarvitsivat sekä D2:n kaltaisten reseptorien stimulaatiota helpottaakseen sukupuolielinten refleksien estoa ja vaativat myös enemmän D2:ta sisältävien solujen stimulaatiota siemensyöksyjen saavuttamiseksi. Tämä on myös yhdenmukainen Hull-mallin kanssa.
D2-reseptorin lyhyt ja pitkä muoto vaihtelevat kooltaan ja toiminnaltaan (Moreira ym., 2010). Tässä tarkastelimme D2 pitkää muotoa, joka toimii ensisijaisesti postsynaptisesti. Emme kuitenkaan tutkineet D1-reseptorien toimintaa. Siitä huolimatta D2-reseptorien kolokalisaatio Fos:n kanssa viittaa D1-reseptorien jonkinlaiseen osallisuuteen, koska tämä aktivaatio oletettavasti vaatisi D1-stimulaatiota. Stimulantit, kuten kokaiini, d-amfetamiini ja metamfetamiini, nostavat voimakkaasti striatalin Fos-tasoja (Graybiel et ai., 1990; Carney et ai., 1991; Young et ai., 1991), mikä tarkoittaa, että lisääntynyt dopamiini lisää c-fos-ilmentymistä. Selektiiviset D1-reseptorin antagonistit estivät kuitenkin tämän kasvun.Young et ai., 1991). Muut tutkimukset osoittavat kuitenkin D1- ja D2-reseptorien interaktiivisia vaikutuksia Fos-ilmentymiseen, kuten lateraalisessa habenulassa (Wirtshafter ja Krebs, 1997). Wirtshafter ja Krebs injektoivat rotille erilaisia annoksia selektiivistä D2-agonisti-kinpirolia joko yksinään tai yhdistelmänä selektiivisen D1-agonistin A-77636 eri annosten kanssa. Yksittäin selektiiviset agonistit aiheuttivat pieniä lisäyksiä fos-ir-arvossa, mutta näiden kahden lääkkeen yhdistelmät johtivat voimakkaaseen nousuun (Wirtshafter ja Krebs, 1997), mikä osoittaa tärkeän synergismin D1- ja D2-reseptorien välillä (Gerfen et ai., 1995; Keefe ja Gerfen, 1995). Koska lisääntynyt c-Fos:n ilmentyminen liittyy depolarisaatioon, c-Fos:n lisääntynyt säätely D2:ta sisältävissä soluissa parittelun jälkeen, kuten tässä esitetään, tukee ajatusta, että mPOA:n D1:llä ja D2:lla on synergistisiä vaikutuksia paritteluun. Nimittäin parittelun alkaminen stimuloi D1-reseptoria alhaisilla tai kohtalaisilla dopamiinitasoilla, mitä seuraa sitten voimakas tai pitkittynyt D2-reseptorien stimulaatio, mikä muuttaa autonomista tasapainoa edistämään siemensyöksyä.
Mitä tulee seksuaaliseen kokemukseen, osoitamme, että parittelu stimuloi soluja, jotka sisältävät oletettuja D2-reseptoreita mPOA:ssa ja että tämä stimulaatio on voimakkaampaa aiemmin kokemattomien urosten mPOA:ssa, jotka ovat kokeneet ensimmäisen seksuaalisen kohtaamisen. Tämä havainto on huomionarvoinen, koska seksuaalisesti kokeneet eläimet osoittavat lisääntynyttä seksuaalista tehokkuutta, mikä on osoituksena siemensyöksyfrekvenssin lisääntymisestä ja latenssien vähenemisestä kokemattomiin miehiin verrattuna (Hull ja Dominguez, 2015). Tällä erolla D2:n aktivoinnissa voi olla rooli käyttäytymiseroissa, jotka kestävät kokeneiden ja kokemattomien eläinten välillä. Erityisesti voidaan spekuloida, että dopamiiniherkät solut vaativat vähemmän stimulaatiota toistuvalla ja pitkittyneellä kokemuksella, mistä on osoituksena pienempi kolokalisaatio kokeneilla vs. kokemattomilla eläimillä tutkimuksessamme. Lopuksi löysimme myös suuremman määrän oletettuja D2-ir-soluja kokeneista eläimistä. Tämä muutos korreloi seksuaalisen käyttäytymisen kanssa. Seksuaalisesti kokeneet eläimet tarvitsivat vähemmän aikaa parittelun aloittamiseen, mikä on osoituksena lisääntymislatenssista. Tämä latenssi korreloi negatiivisesti D2-ir-solujen lukumäärän kanssa, mikä tarkoittaa, että mitä enemmän aikaa tarvitaan ennen parittelua, sitä pienempi on D2-ir-solujen lukumäärä. Tämä viittaa siihen, että seksuaalinen kokemus kohotti D2-tasoja, mikä liittyy vähentyneeseen paritteluviiveeseen. Muut kokemuksesta riippuvaiset käyttäytymistoimenpiteet korreloivat Fos-irin kanssa. Fos-ir-solujen määrä korreloi positiivisesti kokemattomien eläinten sisääntulokertojen lukumäärän kanssa, mikä viittaa siihen, että seksuaalisesti kokemattomat eläimet tarvitsivat enemmän mPOA:n stimulaatiota siemensyöksyjen saavuttamiseksi, koska nämä eläimet pariutuivat vain yhden siemensyöksyn kanssa. Päinvastoin, toistuva stimulaatio, joka johtuu useasta sisäänkäynnistä, on saattanut johtaa suurempaan aktiivisuuteen mPOA:ssa. Lopuksi Fos-soluja sisältävien D2-solujen määrä korreloi positiivisesti intromissionien lukumäärän kanssa, jälleen seksuaalisesti kokemattomilla eläimillä. Kuten Fosissa, tällä voi olla kaksitahoinen selitys. Nimittäin seksuaalisesti kokemattomat eläimet tarvitsivat enemmän D2:ta sisältävien solujen stimulaatiota siemensyöksyjen saavuttamiseksi, ja päinvastoin pitkittynyt altistuminen dopamiinille, joka johtui suuremmasta sisäänkäynnistä, saattoi johtaa suurempaan aktiivisuuteen mPOA:ssa.
Lopuksi osoitimme, että seksuaalinen kokemus helpotti seksuaalista käyttäytymistä ja että näillä muutoksilla oli käyttäytymiskorrelaatioita mPOA:ssa. Nimittäin solut, jotka sisältävät D2:n kaltaisia dopamiinireseptoreita, ovat kolokalisoituneet Fosin kanssa. Tämä kolokalisaatio oli suurin eläimillä, jotka parittelivat ensimmäistä kertaa. Seksuaalisesti kokeneiden eläinten mPOA:ssa oli myös enemmän D2:n kaltaisia dopamiinireseptoreita. Nämä hermokorrelaatit ja niihin liittyvä neuroplastisuus voivat selittää ainakin osittain käyttäytymismuutoksia, jotka seuraavat seksuaalista kokemusta urosrotissa.